Kinderen en voedingssuppletie: probiotica
 Goede start
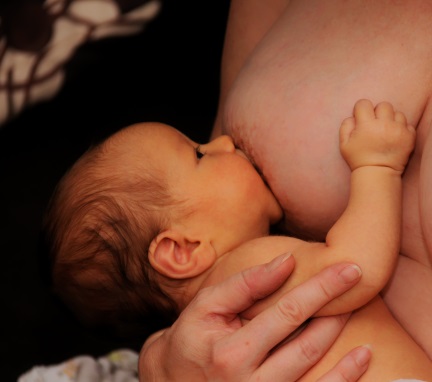
Goede start
Lactobacillen en bifidobacteriën behoren tot de categorie van probiotische bacteriën, ook wel probiotica genaamd. De belangrijkste functies van probiotica voor de gezondheid zijn het beschermen van de darmwand, het in stand houden van een gevarieerde darmmicrobiota, wat onder meer van belang is voor een goede spijsvertering en stoelgang, en het bevorderen van een goede werking van het immuunsysteem, onder meer door communicatie via het Gut Associated Lymphoid Tissue (GALT; immuunsysteem van de darmmicrobiota) met het immuunsysteem.
Uit twee recente publicaties komt naar voren dat de eerste 1.000 levensdagen van een baby van cruciaal belang zijn voor een goede ontwikkeling van het darmmicrobioom en de gezondheid later in het leven. Britse wetenschappers hebben aan de hand van maandelijkse ontlastingsmonsters van 903 kinderen vanaf 3 maanden tot 46 maanden oud drie ontwikkelingsfasen van de darmmicrobiota onderscheiden: de ontwikkelingsfase (3-14 maanden), de transitiefase (15-30 maanden) en de stabiele fase (31-46 maanden). Het al dan niet krijgen van borstvoeding en de wijze van geboorte bepalen in hoge mate de samenstelling van het darmmicrobioom in de verschillende fasen.
Een andere groep wetenschappers heeft op basis van 10.913 ontlastingsmonsters van 783 baby’s uit dezelfde studie (The Environmental Determinants of Diabetes in the Young; TEDDY) de ontwikkeling van het jonge darmmicrobioom bestudeerd in verband met bètacel auto-immuniteit, diagnose van type I-diabetes of gebruik van antibiotica of probiotica. Gaandeweg het onderzoek ontwikkelden sommige baby’s auto-immuniteit tegen bètacellen en type I-diabetes. Hun microbioom bleek af te wijken van dat van de baby’s die gevrijwaard bleven van type I-diabetes. Het microbioom van deze laatste groep bevatte meer genen die te maken hebben met fermentatie en de productie van korteketenvetzuren, waarvan in eerder onderzoek al een beschermend effect is vastgesteld.
Baby’s worden steriel geboren. De eerste kolonisatie vindt plaats tijdens de passage door het geboortekanaal. De baby komt dan in aanraking met darmmicrobiota-bacteriën vanuit de vagina en anus van de moeder. Vlak na de geboorte is de darm nog zuurstofrijk, zodat alleen de aerobe bacteriën (voornamelijk E.coli– en Enterococcus-stammen) overleven. Zij zorgen ervoor dat er binnen een paar weken een zuurstofarm milieu in de darm ontstaat dat geschikt is voor de tweede kolonisatie, nu met anaerobe bacteriën. Ook deze anaerobe bacteriestammen (o.a. Lactobacillus, Bifidobacterium en Bacteroides) ontvangt de baby van de moeder: via huidcontact en door het drinken aan de borst. Na zo’n 2,5 jaar is de darmmicrobiota uitgegroeid tot een rijpe, ‘volwassen’ darmmicrobiota.
Zoals hierboven al aangegeven hebben kinderen die via een keizersnede zijn geboren en kinderen die flesvoeding krijgen in plaats van borstvoeding een darmmicrobiota die duidelijk afwijkt van de darmmicrobiota van kinderen bij wie de kolonisaties op een natuurlijke manier zijn verlopen. Met name bij flesgevoede kinderen is een toename te zien van stammen die zorgen voor rottingsprocessen in de darmen.
 Necrotiserende enterocolitis
Necrotiserende enterocolitis
Ook bij te vroeg geboren baby’s is er vaak sprake van een afwijkende kolonisatie van de darm en daaruit voortvloeiende effecten op de gezondheid.
Necrotiserende enterocolitis is een ernstige, levensbedreigende darmontsteking die met name voorkomt bij te vroeg geboren kinderen met een te laag geboortegewicht. Ongeveer 7% van de kinderen die worden geboren na een zwangerschap van minder dan 32 weken krijgt necrotiserende enterocolitis. Van deze kinderen overlijdt 15-30%.
Lactobacillus acidophilus kan in sommige gevallen een gunstig, remmend effect hebben op het ontstaan van deze aandoening. In een Oostenrijks onderzoek bleek een combinatie van Lactobacillus acidophilus en Bifidobacterium infantis de kans op necrotiserende enterocolitis te verminderen bij kinderen die borstvoeding kregen. Bij kinderen die flesvoeding kregen werd echter geen effect waargenomen.
In een Duits onderzoek werden vergelijkbare resultaten gevonden voor deze combinatie van bacteriestammen: minder risico op necrotiserende enterocolitis, betere gewichtstoename, minder darmoperaties en minder overlijden.
Ook probiotica die Bifidobacterium infantis bevatten blijken het risico op necrotiserende enterocolitis te kunnen verminderen.
Griep en verkoudheid
Oudere kinderen hebben aanzienlijk minder last van symptomen van griep en verkoudheid als ze Lactobacillus acidophilus alleen of in combinatie met Bifidobacterium lactis krijgen, zo blijkt uit een Amerikaans onderzoek. In het winterseizoen werden 326 kinderen in de leeftijd van 3-5 jaar gevolgd. Gedurende zes maanden kreeg een groep van 110 kinderen dagelijks Lactobacillus acidophilus, een groep van 112 kinderen kreeg Lactobacillus acidophilus plus Bifidobacterium lactis en 104 kinderen kregen een placebo. Zowel het enkelvoudige probioticum als de probioticamix bewerkstelligden een aanzienlijke vermindering van het aantal gevallen van koorts (- 53% resp. – 72,7%), hoesten (- 41,4% resp. – 62,1%) en neusverkoudheid (- 28,2% resp. – 58,8%) ten opzichte van placebo. De duur van deze symptomen, het gebruik van antibiotica en het aantal dagen afwezigheid wegens ziekte waren significant minder in de probioticagroepen.
Allergie
In een twee jaar durende studie van het Wilhelmina Kinderziekenhuis in Utrecht is gekeken naar een mogelijk effect van probiotica op de ontwikkeling van allergieën bij jonge kinderen. Aan het onderzoek namen 156 zwangere vrouwen met een erfelijke aanleg voor eczeem deel. De ene helft van de vrouwen kreeg gedurende de laatste zes weken van de zwangerschap een probiotica-mix bestaande uit Bifidobacterium bifidum, Bifidobacterium lactis en Lactococcus lactis, de andere helft een placebo. De kinderen kregen de suppletie gedurende hun eerste levensjaar. Gedurende de eerste drie maanden na de geboorte werd bij 29% van de baby’s in de placebogroep eczeem vastgesteld door de ouders. In de probioticagroep was dit percentage slechts 12, hetgeen neerkomt op een risicovermindering van 58%. Na verloop van tijd werd de risicovermindering minder, maar nog altijd aanzienlijk. Op eenjarige leeftijd hadden de kinderen in de probioticagroep 26% minder kans op eczeem en toen ze twee jaar oud waren nog altijd 22% minder kans. Vooral dit laatste percentage is interessant omdat de probioticasuppletie een jaar eerder al was gestopt.
Uit een vervolgstudie bleek echter dat het gunstige effect van een jaar lang probioticasuppletie direct na de geboorte op zesjarige leeftijd geheel was verdwenen en niet leidde tot primaire preventie van astma. Volgens de onderzoekers is dit begrijpelijk omdat de darmmicrobiota zeker tot het vierde levensjaar nog in ontwikkeling kan zijn. Voor een langdurig effect zou wellicht een langere periode van probioticasuppletie noodzakelijk zijn.
Suppletie met Lactobacillus reuteri vanaf de laatste weken van de zwangerschap en aan de baby gedurende het eerste levensjaar vermindert de prevalentie van type I-allergie (IgE-afhankelijk) op tweejarige leeftijd. Lactobacillus reuteri-suppletie vermindert de respons op allergenen en mitogenen en versterkt de immuun regulerende capaciteit bij baby’s.
Ook kinderen met berkenpollenallergie kunnen baat hebben bij een probioticamix, bestaande uit Lactobacillus acidophilus en Bifidobacterium lactis. In een Fins onderzoek kregen 47 kinderen (gemiddelde leeftijd 9 jaar) met gediagnosticeerde pollenallergie gedurende het berkenpollen-seizoen (maart-juni) ofwel probiotica (1,25 x 109 kve Lactobacillus acidophilus plus 3,75 x 109 kve Bifidobacerium lactis) ofwel een placebo. De probiotica bleken de infiltratie van eosinofielen in het neusslijm tegen te gaan en zodoende symptomen als een loopneus of een verstopte neus te verminderen.
 Diarree
Diarree
Uit een review van gerandomiseerde gecontroleerde studies is naar voren gekomen dat veel probiotica, met name Lactobacillus rhamnosus, een gunstig effect kunnen hebben bij de behandeling van acute diarree bij baby’s en kinderen. Volgens Deens onderzoek kan een combinatie van Lactobacillus rhamnosus en Lactobacillus reuteri bij baby’s en peuters in de leeftijd van 6-36 maanden die met een rotavirusinfectie in het ziekenhuis liggen de diarreefase met 20% verkorten. Ook bij gezonde baby’s en kinderen (leeftijd 9-44 maanden) kan deze combinatie de duur van diarree verkorten. Direct met suppletie starten bij de eerste symptomen kan de hersteltijd bijna halveren (- 43%).
Regurgitatie, het terugvloeien van voedsel of maagsap, is een veelvoorkomend verschijnsel bij baby’s. Behalve ongemak heeft het verder meestal geen gevolgen voor de ontwikkeling of de gezondheid. In een Italiaans onderzoek is vastgesteld dat dagelijks 100 miljoen kve Lactobacillus reuteri gedurende een maand bij baby’s met regurgitatie gasvorming in de maag vermindert, de maaglediging versnelt en de frequentie van regurgitatie sterk vermindert.
Oligosacchariden uit moedermelk spelen een belangrijke rol bij de vorming van de darmmicrobiota. Bifidobacterium infantis is de enige darmbacterie die in staat is deze oligosacchariden te consumeren en te verteren.
Uit in-vitro onderzoek blijkt onder meer dat Bifidobacterium infantis veel beter groeit in aanwezigheid van oligosacchariden uit moedermelk dan andere bacteriestammen. In darmcellen van te vroeg geboren baby’s ontplooit Bifidobacterium infantis anti-ontstekingsactiviteit en zorgt voor een verminderde doorlaatbaarheid van de darm.
Bij te vroeg geboren baby’s die naast borstvoeding Bifidobacterium infantis krijgen, nemen de aantallen Bifidobacterium infantis in de feces toe en die van Enterobacteriacaea af.
In een onderzoek met gezonde baby’s jonger dan 8 maanden bleek toevoeging van Bifidobacterium lactis aan een babyformule met aangezuurde melk de kans op diarree met bijna de helft te verminderen.
In een Duits onderzoek met te vroeg geboren baby’s (minder dan 37 weken zwangerschap) was er sprake van meer gewichtstoename in de groep die naast antibiotica tevens werd gesuppleerd met Bifidobacterium lactis dan in de placebogroep. In de groep die alleen Bifidobacterium lactis kreeg was de pH van de feces aanzienlijk lager en de concentraties lactaat en acetaat waren respectievelijk 42 en 38% hoger dan in de placebogroep. Deze omstandigheden zijn gunstig voor de groei van bifidobacteriën, hetgeen een beschermend effect tegen ontstekingen in het spijsverteringskanaal kan hebben.
FOS
Fructo-oligosacchariden (FOS) bevorderen selectief de groei van darmbacteriën. FOS werken symbiotisch samen met zuur producerende bacteriën, zoals lactobacillen en bifidobacteriën: FOS bevorderen de groei van deze bacteriën die op hun beurt enzymen produceren om de fructo-oligosacchariden te verteren. Oligosacchariden in moedermelk bevorderen selectief de groei van lactobacillen en bifidobacteriën in de darm van de baby. Uit meerdere onderzoeken is gebleken dat toevoeging van een prebioticum met FOS aan de flesvoeding van baby’s een soortgelijk effect heeft en de stoelgang zachter maakt.
(WD)
– Hoofdartikel
– Vitaminen
– Mineralen
– Omega-3 vetzuren
Bronnen
- Lactobacillus; website Natural Medicines. Geraadpleegd 09-2018.
- Leyer GJ et al.: Probiotic effects on cold and influenza-like symptom incidence and duration in children; Pediatrics 124(2):e172-e179, 2009.
- Niers L et al.: The effects of selected probiotic strains on the development of eczema (the PandA study); Allergy 64(9):1349-1358, 2009.
- Gorissen DMW et al.: Preventive effects of selected probiotic strains on the development of asthma and allergic rhinitis in childhood. The Panda study; Clinical and Experimental Allergy 44(11):1431-1433, 2014.
- Ouwehand AC et al.: Specific probiotics alleviate allergic rhinitis during the birch pollen season; World Journal of Gastroenterology 15(26):3261-3268, 2009.
- Chouraqui JP, Van Egroo LD, Fichot MC: Acidified milk formula supplemented with bifidobacterium lactis: impact on infant diarrhea in residential care settings; Journal of Pediatric Gastroenterology and Nutrition 38(3):288-292, 2004.
- Mohan R et al.: Effects of Bifidobacterium lactis Bb12 supplementation on body weight, fecal pH, acetate, lactate, calprotectin, and IgA in preterm infants; Pediatric Research 64(4):418-422, 2008.
- Underwood MA et al.: Bifidobacterium longum subspecies infantis: champion colonizer of the infant gut; Pediatric Research 77(1-2):229-235, 2015.
- Repa A et al.: Probiotics (Lactobacillus acidophilus and Bifidobacterium bifidum) prevent NEC in VLBW infants fed breast milk but not formula; Pediatric Research 77(2):381-388, 2015.
- Härtel C et al.: Prophylactic use of Lactobacillus acidophilus/Bifidobacterium infantis probiotics and outcome in very low birth weight infants; Journal of Pediatrics 165(2):285-289.e1, 2014.
- Forsberg A et al.: Pre- and post-natal Lactobacillus reuteri supplementation decreases allergen responsiveness in infancy; Clinical and Experimental Allergy 43(4):434-442, 2013.
- Indrio F et al.: Lactobacillus reuteri accelerates gastric emptying and improves regurgitation in infants; European Journal of Clinical Investigation 41(4):417-422, 2011.
- Szajewska H, Mrukowicz JZ: Probiotics in the treatment and prevention of acute infectious diarrhea in infants and children: a systematic review of published randomized, double-blind, placebo-controlled trials; Journal of Pediatric Gastroenterology and Nutrition 33(Suppl 2):S17-S25, 2001.
- Rosenfeldt V et al.: Effect of probiotic Lactobacillus strains on acute diarrhea in a cohort of nonhospitalized children attending day-care centers; Pediatric Infectious Disease Journal 21(5):417-419, 2002.
- Rosenfeldt V et al.: Effect of probiotic Lactobacillus strains in young children hospitalized with acute diarrhea; Pediatric Infectious Disease Journal 21(5):411-416, 2002.
- Moro G et al.: Dosage-related bifidogenic effects of galacto- and fructooligosaccharides in formula-fed term infants; Journal of Pediatric Gastroenterology and Nutrition 34(3):291-295, 2002.
- Stewart CJ et al.: Temporal development of the gut microbiome in early childhood from the TEDDY study; Nature 562(7728):583-588, 2018.
- Vatanen T et al.: The human gut microbiome in early-onset type 1 diabetes from the TEDDY study; Nature 562(7728):589-594, 2018.
